Обучайтесь и развивайтесь всесторонне вместе с нами, делитесь знаниями и накопленным опытом, расширяйте границы знаний и ваших умений. поделиться знаниями или
запомнить страничку
- Все категории
- экономические
43,502 - гуманитарные
33,638 - юридические
17,908 - школьный раздел
609,184 - разное
16,874
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Відомо: Dповітря(газу)=1,656
Знайти: ρ(газу)-? Формулу газу-?
Розв’язання:
І спосіб
1. Знайдемо молярну масу. Dповітря(газу)=М(газу)/М(повітря), звідси молярна маса М(газу)=Dповітря(газу)•М(повітря)=1,656•29 г/моль=48 г/моль. Знайдемо густину – це маса 1 л газу – за формулою ρ=М/VМ, де VM – постійна величина і дорівнює 22,4 л/моль за н. ρ(газу)=48 г/моль:22,4 л/моль=2,1428 г/л. Таку густину за н. має озон О3. ІІ спосіб
1. Знайдемо молярну масу. Dповітря(газу)=М(газу)/М(повітря), звідси молярна маса М(газу)=Dповітря(газу)•М(повітря)=1,656•29 г/моль=48 г/моль. Оскільки M г/моль=Mr, тому Mr(газу)=48. Цим газом може бути озон О3. Обчислюємо кільксть речовини газу об’ємом 1 л за формулою n=V/VМ, де VМ – постійна величина і за н. дорівнює 22,4 л/моль,
n=1 л : 22,4 л/моль=0,045 моль. Обчислюємо масу газу. З формули n=m/M знаходимо масу m=M•n. m(газу)=48 г/моль•0,045 моль=2,14 г. Відповідь: ρ(газу)=2,14 г/л або m(газу)=2,14 г, озон О3.
Відносна густина газу D — це величина, яка дорівнює відношенню маси певного об’єму одного газу до маси такого самого об’єму іншого газу за однакових умов.
Відношення мас рівних об’ємів газів за однакових умов дорівнює відношенню їх молярних (відносних молекулярних) мас.
Mr(повітря) = 29.
Задача 1. Обчисліть відносну густину сульфур (IV) оксиду за воднем і повітрям.
Знаходимо відноснугустину сульфур (IV) оксиду за воднем.
Яка відносна густина сульфур (IV) оксиду за повітрям?
Відповідь: DН2(SО2) = 32, D(пов. )(SО2) = 2,2.
Задача 2. Маса газоподібної сполуки об’ємом 1 л (н. ) дорівнює 1,52 г. Знайдіть молярну масу газу і його густину за воднем.
Знаючи масу газу об’ємом 1 л (н. ), обчислюємо його молярну масу за формулою (6):
Визначаємо густину газу за воднем за формулою
Відповідь: молярна маса газу дорівнює 34 г/моль; густина за воднем дорівнює 17.
Задачі для самостійного розв’язування
Густина газу за воднем дорівнює 17. Визначте молярну масу газу.
Обчисліть густину за гелієм: а) азоту; б) кисню; в) амоніаку; г) метану.
Визначте відносну густину за воднем і за повітрям карбон(ІУ) оксиду.
Теорія
Згідно закону Авогадро — різні гази однакових об’ємів містять однакову кількість молекул. Проте, маси цих об’ємів будуть різними, оскільки молекулярні маси газів є різними. Один газ буде важчий від іншого у стільки раз, у скільки раз відносна молярна маса одного газу є важчою за відносну молярну масу іншого.
Відносна густина газів — це відношення, що показує, у скільки разів маса певного об’єму одного газу більша або менша від маси такого самого об’єму іншого газу за однакових умов.
Молярний об’єм усіх газів за нормальних умов є однаковим — (22,4) л.
Звідси випливає, що відносну густину газів можна обчислити за формулами:
— відносна густина газу. Внизу справа, після літери
пишуть формулу газу, відносно якого обчислюють густину іншого газу.
Наприклад: густина за киснем —
, густина за гелієм —
, густина за повітрям —
(для обрахунків використовують середню відносну молекулярну масу повітря за нормальних умов, вона дорівнює 29).
знаючи відносну густину газу і молярну масу одного газу, можна обчислити молярну масу іншого газу:
Обчисли відносну густину сірководню
Обчислення проведемо за формулою:
Підставимо значення молекулярних мас у формулу:
Відповідь: відносна густина сірководню за воднем — (17).
Відносна густина метану
за воднем — 8. Обчисліть його молярну масу.
Для обрахунків використаємо формулу:
Відповідь: молярна маса метану
— (16) г/моль.
Густина — це маса одного об’єму речовини:
Молярну масу можна обчислити, знаючи густину газу
(масу одного літра за нормальних умов):
— молярний об’єм газу, дорівнює (22,4) л.
Обчисли молярну масу кисню, якщо один літр цього газу важить (1,429) г.
Згідно умови густина дорівнює (1,429) г/моль.
Відповідь: молярна маса кисню — (32) г/моль.
7 клас нова програма
Оберіть правильне твердження:
Об’єм 8900 кг міді буде 8900 м3. Об’єм 1 кг міді буде 8900 м3.
Маса 1 м3 міді становить 8900 кг.
У бідон об’ємом 0,01 м3 налито гас. Оберіть правильне твердження.
Маса 1 см3 перевищує 1 г.
Густина гасу менше ніж 1000 кг/м3.
Маса гасу в бідоні менше ніж 5 кг.
Об’єм суцільного чавунного бруска дорівнює 70 см3. Оберіть правильне твердження.
Об’єм 1 г чавуна дорівнює 7 см3.
Маса бруска менше ніж 600 г.
Брусок такого самого об’єму з алюмінію мав би більшу масу.
Розв᾿язати задачі за усіма правилами запису:
Маса суцільного металевого бруска, об᾿єм якого 40 см3 дорівнює 280 г. Визначте густину металу бруска.
Місткість цистерни 60 м3. Скільки кілограм бензину можна в неї налити?
Скільки будівельних цеглин розміром 250 х 120 х 65 мм дозволяють перевозити на автомашині вантажопідйомністю 4 т?
Густина речовин (ρ)
кг/м3
г/см3
кг/м3
г/см3
Бензин
710
0,7
Гас
800
0,8
Цегла
1600
1,6
Чавун
7000
7
Об’єм суцільної алюмінієвої кульки дорівнює 10 см3. Оберіть правильне твердження.
Маса кульки перевищує 40 г.
Маса 1 см3 алюмінію перевищує 2 г.
Об’єм 1 г алюмінію дорівнює 2,7 см3.
Маса квадратної пластинки зі стороною 5 см дорівнює 30 г. Товщина пластинки 2 мм. Оберіть правильне твердження.
Об’єм пластинки понад 3 см3.
Густина пластинки більше ніж 8 г/см3.
Густина пластинки менше ніж 5 г/см3.
Маса деталі 25,5 г, а її об’єм дорівнює 3 см3. Оберіть правильне твердження.
Якщо деталь суцільна, то вона може бути виготовлена з міді.
Якщо деталь порожниста, то вона може бути виготовлена зі срібла.
1 см3 цієї деталі може мати масу 7,8 г.
Однорідне тіло масою 80 г має об᾿єм 20 см3. Визначте густину речовини, з якої складається тіло.
Визначте масу водню, що наповняє аеростат, об’єм якого 1500 м3.
Мідна кулька має масу 840 г, а об’єм 120 см3. Суцільна ця куля чи порожниста?
Густина речовин (ρ)
кг/м3
г/см3
кг/м3
г/см3
Водень
0,09
0,00009
Алюміній
2700
2,7
Мідь
8900
8,9
Срібло
10500
10,5

Густина речовини. Одиниці густини. Розв’язування задач. Фізика 7 клас. Урок 25
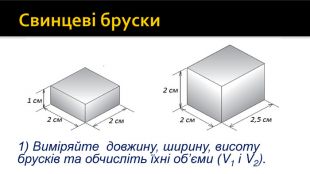
Свинцеві бруски1) Виміряйте довжину, ширину, висоту брусків та обчисліть їхні об’єми (V1 і V2).
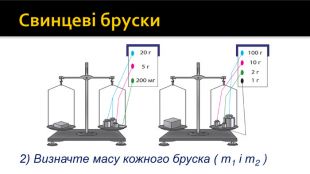
Свинцеві бруски2) Визначте масу кожного бруска ( m1 і m2 )

Свинцеві бруски3) Визначте відношення маси кожного бруска до його об’єму: Маса свинцю об’ємом 1 см3 дорівнює 11,3 г

Означення густини. Густина речовини — це фізична величина, яка характеризує речовину і дорівнює відношенню маси суцільного тіла, виготовленого з цієї речовини, до об’єму цього тіла:де ρ («ро»)— густина речовини; m — маса тіла; V — об’єм тіла (об’єм, зайнятий речовиною)

Одиниці густини в СІУ СІ одиницею маси є кілограм, а одиницею об’єму — метр кубічний, тому одиниця густини в СІ — кілограм на метр кубічний:

Одиниці густини в СІЗастосовують також одиницю густини грам на сантиметр кубічний (г/см3)

Порівнюємо густини різних речовин. Об’єм кожного кубика дорівнює 1 см3, маси кубиків зазначені на рисунку.

Від яких чинників залежить густина речовини. Густина суттєво залежить від агрегатного стану і температури речовини.
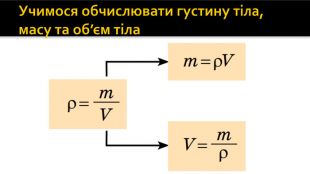
Учимося обчислювати густину тіла, масу та об’єм тіла

Дайте відповіді на питання. Дайте означення густини речовини. Які вимірювання необхідно здійснити, щоб визначити густину речовини? Які одиниці густини ви знаєте? Як подати густину в грамах на сантиметр кубічний (г/см3), якщо відоме її значення в кілограмах на метр кубічний (кг/м3)? Чи залежить густина речовини від температури та агрегатного стану речовини? Якщо залежить, то як? Відповідь поясніть. Як обчислити масу тіла за його густиною та об’ємом? Як визначити об’єм тіла, знаючи його густину та масу?

Розв’язування задач (усно)У циліндрі під поршнем міститься кисень. Поршень починають опускати. Як при цьому змінюється: а) маса газу? б) об’єм газу? в) густина газу?

Номер слайду 13
Розв’язування задач (усно)Густина платини дорівнює 21500 кг/м3. Якою є маса платини об’ємом 1 м3? об’ємом 1 см3?

Номер слайду 14
Розв’язування задач (усно)Значення якої величини ми насправді порівнюємо, коли говоримо: «легкий, мов повітря», «важкий, як свинець»?

Номер слайду 15
Розв’язування задач. Два кубики мають однакову масу. Перший кубик виготовлений з оргскла, другий — з дуба. Об’єм якого кубика є меншим і в скільки разів?

Номер слайду 16
Домашнє завдання. Вивчити: § 16 Впр. 16 (4) – усно. Впр. 16 (5) – письмово
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Відносна густина газів
З курсу фізики ти знаєш, що для порівняння маси й об’єму різних тіл, використовують фізичну величину — густину, яка чисельно дорівнює відношенню маси тіла до його об’єму (позначається грецькою літерою р — читається «ро»). Одиниця густини — кілограм на кубічний метр (кг/м3) або грам на кубічний сантиметр (г/см3):ρ = m/V.
Наприклад, для кисню 02, молярна маса якого 32 г/моль, а молярний об’єм (для будь-якого газу за нормальних умов) дорівнює 22,4 л/моль, густина становить:ρ = M/Vm;ρ(O2) = (32 г/моль)/(22,4 л/моль) = 1,43 г/л.
Часто буває важливо знати легший чи важчий один газ від іншого чи від повітря (суміш газів). Це необхідно, аби визначити застосування газу в практичній діяльності людини чи зрозуміти, в яких шарах атмосфери він концентрується, а може, вирішити, як розмістити циліндр для збирання даного газу — догори дном чи отвором догори. З цією метою користуються поняттям «відносна густина газу». Відносна густина газу — величина, що показує, у скільки разів відносна молекулярна маса одного газу більша або менша від відносної молекулярної маси іншого газу, взятого для порівняння. D = Mr1/Mr2.
Оскільки в однакових об’ємах різних газів за однакових умов міститься однакова кількість молекул, то відносна густина газу показує, у скільки разів молекула одного газу важча або легша від молекули іншого газу. Наприклад, відносна молекулярна маса кисню 32, а водню — 2. Це означає, що кисень у 16 разів важчий від водню, тобто його відносна густина за воднем дорівнює 16. Найчастіше густину різних газів визначають саме відносно водню як найлегшого з усіх газів або відносно повітря. В станньому разі потрібно ділити на 29 — середню молекулярну масу повітря:DH2 = Mr/2; Dпов. = Mr/29. Відносну густину газу можна визначити і як відношення маси певного газу до маси такого самого об’єму іншого газу, взятих за однакових умов:D = m1/m2.
Наприклад, маса 1 л С02 дорівнює 1,98 г, а маса 1 л Н2 за таких самих умов — 0,09 г. Звідси відносна густина карбон(ІV) оксиду С02 за воднем становить 1,98 : 0,09 = 22, тобто вуглекислий газ СO2 у 22 рази важчий від водню або водень у 22 рази легший від вуглекислого газу С02. Знаючи густину одного газу відносно іншого, можна визначити молекулярну, отже, й молярну масу газу за формулами:M = 2DH2; M = 29Dпов. Молярна маса газу дорівнює його густині відносно іншого газу, помноженій на молярну масу останнього. Знаючи густину газу, можна обчислити його молярний об’єм за відношенням молярної маси газу до його густини:Vm = M/ρ (л/моль).
ВИСНОВКИВідносна густина газу показує, у скільки разів один газ важчий або легший від іншого. Відносну густину газу можна обчислити за будь-яким іншим газом. Найчастіше порівнюють гази з воднем або повітрям. Знаючи густину, можна визначити молярну масу невідомого газу.
Завдання для самоконтролю1. Густина сульфур(IV) оксиду за воднем дорівнює 32, отже, його відносна молекулярна маса становить (а) 8; (б) 16; (в) 32; (г) 64. Густина карбон(IV) оксиду за воднем дорівнює (а) 10; (б) 22; (в) 20; (г) 25. Молярна маса газуватої речовини, густина якої 1,96 г/л, дорівнює (а) 11 г/моль; (б) 22 г/моль; (в) 44 г/моль; (г) 88 г/моль;4. Якщо густина пари деякої речовини за воднем дорівнює 4, то її густина за гелієм становить(а) 8; (б) 2; (в) 4; (г) 1.
Додаткові завдання5. Які з названих газів — вуглекислий газ СO2, метан СН4, сульфур(IV) оксид SO2, гелій Не — можна використати для наповнення дитячих повітряних кульок? Чому?6. Формула газу, для якого відносна густина за повітрям становить 1,586, це (a)N2O; (б) NO; (в) NO2; (г) SO2. 1 л деякого газу за н. має масу 3,17 г. Густина цього газу за гелієм дорівнює (а) 17,00; (б) 17,75; (в) 18,00; (г) 18,45. Хімічним аналізом встановлено, що газ має склад: 27,27 % С і 72,73 % О. Яка формула газу?9*. Обчисли молярну масу газу, якщо його густина за воднем становить 8,5. Визнач формулу газу, знаючи, що масова частка Нітрогену в його складі становить 82,35 %, а Гідрогену — 17,65%.
Буринська, Хімія, 8 класВислано читачами інтернет-сайту.
Книги та підручники безкоштовно скачати, шкільна програма з хімії, домашнє завдання з хімії для 8 класу
Зміст уроку
конспект уроку і опорний каркас
презентація уроку
акселеративні методи та інтерактивні технології
закриті вправи (тільки для використання вчителями)
оцінювання
Практика
задачі та вправи,самоперевірка
практикуми, лабораторні, кейси
рівень складності задач: звичайний, високий, олімпійський
домашнє завдання
Ілюстрації
ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
реферати
фішки для допитливих
шпаргалки
гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
зовнішнє незалежне тестування (ЗНТ)
підручники основні і допоміжні
тематичні свята, девізи
статті
національні особливості
словник термінів
інше
Тільки для вчителів
ідеальні уроки
календарний план на рік
методичні рекомендації
програми
обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь – Образовательный форум.
Інші завдання дивись тут.
Відносна густина газів D обчислюється за формулами:
D=ρ1/ρ2; D=M1/M2; D=Mr1/Mr2, де
ρ1, ρ2 – густини газів, що взяті для порівняння;
M1, M2 – молярні маси газів, що взяті для порівняння;
Mr1, Mr2 – відносні молекулярні маси газів, що взяті для порівняння.
Що характеризує фізична величина густина? Густина – це характеристика речовини, що кількісно визначається відношенням маси до об’єму в абсолютно щільному стані (без урахування пор, тріщин).
Дайте визначення відносної густини газів. Відносна густина одного газу за іншим газом (D) — це відношення густини одного газу (ρ1) до густини іншого газу (ρ2), виміряних за однакових умов.
За якою формулою її обчислюють? D=ρ1/ρ2 чи D=Mr1/Mr2 або D=M1/M2.
Що необхідно знати для обчислення відносної густини одного газу за іншим? Треба знати густини чи відносні молекулярні або молярні маси газів, що беруться для порівняння.
Обчисліть густину хлору за воднем та повітрям.
Знайдемо відносні молекулярні маси хлору й водню:
Учням необхідно було дослідним шляхом добути та зібрати у пробірку нітроген (IV) оксид. Думки учнів щодо способу збирання цього газу розділились. Одні учні вирішили збирати нітроген (IV) оксид, тримаючи пробірку донизу дном, інші — догори дном. Поясніть, хто з них помилявся та чому. Помилялися ті учні, що тримали пробірку догори дном. Відносна густина нітроген (IV) оксиду за повітрям більша за одиницю, тобто нітроген (IV) оксид важчий за повітря, тому для його збирання витісненням повітря посудину тримають донизу дном.
Які з перелічених газів підходять для наповнення аеростатів: водень, кисень, гелій, вуглекислий газ? Відповідь поясніть. Для наповнення аеростатів підходять гази, що є легші за повітря, тобто відносна густина яких за повітрям менша за одиницю. Це водень і гелій.
Зазначте правильне розташування пробірки при збиранні вуглекислого газу. На рис. а, бо пробірку для наповнення газом тримають донизу дном. Обґрунтуйте свій вибір. Відносна густина вуглекислого газу за повітрям більша за одиницю, тобто вуглекислий газ важчий за повітря, тому для його збирання витісненням повітря посудину тримають донизу дном.
Розгляньте малюнок 39 на с. 144 і поясніть, чому саме так розташовані шальки терезів при зважуванні однакових об’ємів зазначених на малюнках газів. Висновки зробили на основі результату обчислення відносної густини газу, яким наповнена ліва кулька, за газом, яким наповнена права кулька: якщо вона дорівнює одиниці, то кульки перебувають у рівновазі, якщо вона більша за одиницю, то газ, яким наповнена права кулька, важчий і ця кулька опуститься вниз, якщо менша за одиницю, то газ, яким наповнена права кулька, легший і ця кулька підніметься вгору.
Як, на вашу думку, розташуються шальки терезів, якщо на них помістити кульки однакового об’єму, наповнені:
а) повітрям і воднем;
Відносна густина водню за повітрям менша за одиницю, тобто водень легший за повітря, тому шалька з кулькою, наповненою повітрям, опуститься вниз.
б) карбон (ІІ) оксидом і азотом;
Відносна густина карбон (ІІ) оксиду за азотом дорівнює одиниці, тобто карбон (ІІ) оксид і азот однакової маси, тому шальки з кульками будуть у рівновазі.
в) вуглекислим газом і хлором;
Відносна густина вуглекислого газу за хлором менша за одиницю, тобто вуглекислий газ легший за хлор, тому шалька з кулькою, наповненою хлором, опуститься вниз.
г) воднем і гелієм?
Відносна густина водню за гелієм менша за одиницю, тобто водень легший за гелій, тому шалька з кулькою, наповнена гелієм, опуститься вниз.
Вправа 86. Що важче: 1 л кисню чи 1 л чадного газу СО (н. )? Відповідь обґрунтуйте.
Відомо: V(О2)=V(CO)=1 л. Знайти: порівняти маси-?
Кількість речовини обчислюємо за формулою v=V/VМ, де VМ – постійна величина і за н. дорівнює 22,4 л/моль.
v(О2)=v(CO)=1 л : 22,4 л/моль=0,045 моль.
З формули v=m/M, де M=Mr г/моль, знаходимо масу m=v•M.
Mr(O2)=2•Ar(O)=2•16=32, M(O2)=32 г/моль.
m(O2)=v(O2)•M(O2)=0,045 моль • 32 г/моль = 1,44 г
Mr(CO)=Ar(C)+Ar(O)=12+16=28, M(CO)=28 г/моль.
m(CO)=v(CO)•M(CO)=0,045 моль • 28 г/моль = 1,26 г
Відповідь: 1 л кисню важчий, ніж 1 л чадного газу (н.
Вправа 87. Ми звикли говорити й чути вислови порожня чашка, порожня банка. Чи правильно це? Наскільки важчою є насправді порожня посудина об’ємом 3 л, яку після викачування повітря герметично закрили, від тієї, що стоїть у кімнаті відкритою (н. )? У відкритій посудині міститься 3 л повітря, тому порожня посудина, яку після викачування повітря герметично закрили, буде легша на величину маси повітря об’ємом 3 л.
Кількість речовини обчислюємо за формулою v=V/VМ, де Vm – постійна величина і за н. дорівнює 22,4 л/моль.
v(повітря)=V(повітря)/Vm=3 л : 22,4 л/моль=0,134 моль.
m(повітря)=v(повітря)•M(повітря)=0,045 моль • 29 г/моль = 1,305 г
Відповідь: відкрита посудина місткістю 3 л на 1,305 г важча, ніж порожня посудина, яку після викачування повітря герметично закрили.
ρ1, ρ2 – густини газів, що взяті для порівняння;
Який фізичний зміст має значення відносної густини газу? Відносна густина газу – фізична величина, що показує, у скільки разів один газ важчий або легший від другого газу, взятого для порівняння.
Запишіть формулу для обчислення відносної густини невідомого газу за воднем, гелієм та вуглекислим газом.
DСО2(газу)=М(газу)/М(СО2) або DCO2(газу)=Мr(газу)/Мr(СО2).
Чому дорівнює середня молярна маса повітря? M(повітря)=29 г/моль
Для визначення відносної густини будь-якого газу за воднем необхідно молярну масу цього газу:
а) помножити на молярну масу водню;
б) розділити на молярну масу водню;
в) скласти з молярною масою водню.
Завдання для засвоєння матеріалу
Вправа 1. Чому для повітря не можна використовувати поняття «молярна маса», а користуються тільки середньою молярною масою? Бо повітря – це суміш газів.
Вправа 2. У скільки разів кисень важчий за:
а) водень; У 16 разів.
DН2(О2)=М(О2)/М(Н2)=32 г/моль : 2 г/моль=16.
б) азот? У 1,1 рази.
DN2(O2)=М(О2)/М(N2)=32 г/моль : 28 г/моль = 1,1
Молярну масу обчислювали за формулою: М=Mr г/моль.
Мr(О2)=2•Ar(О)=2•16=32, тому М(О2)=32 г/моль
Мr(Н2)=2•Ar(Н)=2•1=2, тому М(Н2)=2 г/моль.
Мr(N2)=2•Ar(N)=2•14=28, тому M(N2)=28 г/моль.
Вправа 3. У якого з газів найменша відносна густина за воднем: азот; кисень; гелій?
DН2(N2)=М(N2)/М(Н2)=28 г/моль: 2 г/моль = 14
DН2(О2)=М(О2)/М(Н2)= 32 г/моль : 2 г/моль = 16
DН2(He)=М(He)/М(Н2)= 4 г/моль : 2 г/моль = 2
Mr(Н2)=2•Ar(Н)=2•1=2, тому M(Н2)=2 г/моль.
Mr(N2)=2•Ar(N)=2•14=28, тому M(N2)=28 г/моль.
Mr(O2)=2•Ar(О)=2•16=32, тому M(O2)=32 г/моль.
Мr(Не)=Ar(He)=4, тому M(He)=4 г/моль.
Вправа 4. Знайдіть відносну густину гелію й неону:
а) за воднем;
DН2(He)=М(He)/М(Н2)=4 г/моль : 2 г/моль = 2
DН2(Ne)=М(Ne)/М(Н2)= 20 г/моль : 2 г/моль = 10
б) за повітрям.
Dповітря(He)=М(He)/М(повітря)=4 г/моль : 29 г/моль=0,14.
Dповітря(Ne)=М(Ne)/М(повітря)=20 г/моль : 29 г/моль =0,7.
Mr(He)=Ar(He)=4, тому М(Не)=4 г/моль.
Mr(Ne)=Ar(Ne)=20, тому М(Nе)=20 г/моль.
M(повітря)=29 г/моль.
Вправа 5. Знайдіть відносну густину за гелієм таких газів: H2, CH4, N2, O2, SO2.
DНе(Н2)=М(H2)/М(Нe)=2 г/моль : 4 г/моль = 0,5
DНе(СН4)=М(CH4)/М(Нe)=16 г/моль : 4 г/моль = 4
DНе(N2)=М(N2)/М(Нe)=28 г/моль : 4 г/моль = 7
DНе(О2)=М(O2)/М(Нe)=32 г/моль : 4 г/моль = 8
DНе(SO2)=М(SO2)/М(Нe)=64 г/моль : 4 г/моль = 16
Мr(CH4)=Ar(C)+4•Ar(H)=12+4•1=16, тому M(CH4)=16 г/моль.
Мr(SO2)=Ar(S)+2•Ar(O)=32+2•16=64, тому M(SO2)=64 г/моль.
Вправа 6. Oбчисліть відносну густину:
а) хлору Cl за повітрям;
Dповітря(Cl2)=М(Cl2)/М(повітря)=71 г/моль : 29 г/моль=2,4
б) амоніаку NH3 за киснем;
DO2(NН3)=М(NH3)/М(O2)=17 г/моль : 32 г/моль=0,5
в) пропану C3Н8 за хлором;
DCl2(C3Н8)=М(C3H8)/М(Cl2)=44 г/моль : 71 г/моль=0,6
г) вуглекислого газу CO2 за повітрям;
Dповітря(CO2)=М(CO2)/М(повітря)=44 г/моль : 29 г/моль=1,5.
д) амоніаку NH3 за воднем;
DH2(NH3)=М(NH3)/М(H2)=17 г/моль : 2 г/моль =8,5
е) сірчистого газу SO2 за озоном;
DO3(SO2)=М(SO2)/М(O3)=64 г/моль : 48 г/моль=1,3
є) кисню за азотом N2;
DN2(O2)=М(O2)/М(N2)=32 г/моль : 28 г/моль=1,1
ж) метану СН4 за хлором Cl2.
DCl2(CН4)=М(CH4)/М(Cl2)=16 г/моль : 71 г/моль =0,2
Mr(Cl2)=2•Ar(Cl)=2•35,5=71, тому Mr(Cl2)=71 г/моль.
Mr(NH3)=(Ar(N)+3•Ar(H))=14+3•1=17, тому M(NH3)=17 г/моль.
Мr(СO2)=Ar(С)+2•Ar(O)=12+2•16=44, тому M(СO2)=44 г/моль.
Mr(O3)=3•Ar(О)=3•16=48, тому M(O3)=48 г/моль.
Мr(CH4)=Ar(C)+4•Ar(H)=12+4•1=16, M(CH4)=16 г/моль.
Вправа 7. Відносна густина невідомого газу за воднем дорівнює 17. Визначте молярну масу цього газу. Запишіть його хімічну формулу.
Знайти: М(газу)-? Формулу газу-?
DH2(газу)=М(газу)/М(Н2), звідси М(газу)=DН2(газу)•М(Н2)=DН2(газу)•Мr(Н2) г/моль=17•2•Ar(Н) г/моль= 17•2•1 г/моль=34 г/моль. Формула газу H2S.
Вправа 8. Маса 1 л газу за нормальних умов дорівнює 1,251 г. Обчисліть густину цього газу за воднем.
Відомо: m(газу)=1,251 г, V(газу)=1 л
Молярну масу легко обчислити, знаючи масу 1 літра (бо це густина ρ=m/V=1,215 г/1 л=1,215 г/л).
М=VM•ρ, де VM – постійна величина і дорівнює за н. 22,4 л/моль та ρ=m/V.
М(газу)=22,4 л/моль•1,215 г/л=28 г/моль.
DH2(газу)=M(газу)/M(H2)=28 г/моль : 2 г/моль=14,
де M(H2)=Mr(H2) г/моль=2•Ar(Н) г/моль=2•1 г/моль=2 г/моль
Обчислюємо кільксть речовини газу об’ємом 1 л за формулою n=V/VМ, де VМ – постійна величина і за н. дорівнює 22,4 л/моль,
Обчислюємо молярну масу газу.
З формули n=m/M знаходимо молярну масу М=m/n.
М(газу)=1,251 г / 0,045 моль=28 г/моль.
Обчислюємо відносну густину.
DH2(газу)=M(газу)/M(H2)= 28 г/моль : 2 г/моль=14, де M(H2)=Mr(H2) г/моль=2•Ar(Н) г/моль=2•1 г/моль=2 г/моль
Вправа 9. Густина невідомого газу за повітрям 1,656. Обчисліть масу 1 л цього газу за нормальних умов. Який газ це міг би бути?
Знайти: ρ(газу)-? Формулу газу-?
Знайдемо густину – це маса 1 л газу – за формулою ρ=М/VМ, де VM – постійна величина і дорівнює 22,4 л/моль за н.
З формули n=m/M знаходимо масу m=M•n.
Відповідь: ρ(газу)=2,14 г/л або m(газу)=2,14 г, озон О3.
Вправа 10. Поясніть, чому відносні густини всіх газів за воднем більші за 1. Бо водень – це газ, що має найменшу, у порівнянні з іншими газами, відносну молекулярну масу. Бо інакше всі гази мали б мати однакову чи меншу відносну молекулярну масу у порівнянні з воднем, що є неможливим, бо відносна атомна маса Гідрогену є найменшою.
Вправа 11. Густина деякого газу за киснем дорівнює 2. Чому дорівнює густина цього газу за воднем?
DО2(газу)=M(газу)/M(О2), тому M(газу)/M(О2)=2, звідси
DH2(газу)=M(газу)/M(H2)=64 г/моль : 2 г/моль=32
Вправа 12. Який газ важчий за кисень у 1,5 разу й утворений однаковим елементом (мається на увазі Оксигеном) ?
DО2(Ox)=Mr(Ox)/Mr(О2), тому Mr(Ox)/Mr(О2)=1,5, звідси
Mr(Ox)=1,5•Mr(О2)=1,5•2•Аr(О)=1,5•2•16=48 i Mr(Ox)=xAr(O), тому xAr(O)=48,
звідси x=48:Ar(O)=48:16=3, отже, цим газом може бути озон О3.
Відповідь: озон О3
Важчий у 2 рази й утворений двома елементами (мається на увазі, що один з них є Оксигеном)?
Знайти: формулу газу -?
DО2(газу)=Mr(газу)/Mr(О2), тому Mr(газу)/Mr(О2)=2, звідси
Знайдемо формулу газу.
Припустимо, що молекула газу складається з двох атомів, тоді формула газу матиме вигляд ЕО.
Mr(E)+Mr(O)=64, звідси Mr(E)=64-Mr(O)=64-16=48. Цим елементом є метал Титан Ті, але оксид ТіО не є газом, тому наше припущення не є вірним.
Припустимо, що молекула газу складається з трьох атомів, тоді формули газу матимуть вигляд Е2О або ЕО2.
У першому випадку одержимо: 2•Mr(E)+Mr(O)=64, звідси Mr(E)=(64-Mr(O)):2=(64-16):2=24. Таку молярну масу має Магній, але загальна формула його оксиду інша, тому наше припущення не є вірним.
У другому випадку одержимо: Mr(E)+2•Mr(O)=64, звідси Mr(E)=64-2•Mr(O)=64-2•16=32. Таку молярну масу має Сульфур S, оксид якого SO2 є газом.
Відповідь: сірчистий газ SO2
Вправа 13. Сполуки Карбону й Нітрогену з Оксигеном за однакових умов мають однакову густину. Визначте формули цих сполук.
За умовою задачі сполуки Карбону й Нітрогену з Оксигеном за однакових умов мають однакову густину, тому їхні молярні маси рівні, а значить і відносні молекулярні маси є однакові.
Однакові молекулярні маси мають сполука Оксигену з Карбоном складу СО2 Mr(CO2)=12+2•16=44 і сполука Нітрогену з Оксигеном складу N2O Mr(N2O)=2•14+16=44.
Розділ 10. Електричне поле
Перш ніж вивчати приклади розв’язування задач варто ознайомитися з вказівками до даної теми.
Задача 10. Два точкових заряди q1 = 1 нКл і q2 = -2 нКл знаходяться на відстані l = 100 см один від одного. Визначити модуль напруженості електричного поля E, створеного цими зарядами в точці A, що віддалена на r1 = 80 см від заряду q1 і на r2 = 60 см від q2.
Задача 10. У двох вершинах правильного трикутника зі стороною l = 10 см знаходяться однакові точкові заряди (рис. 10). Визначити напруженість поля E в третій вершині правильного трикутника, якщо потенціал у ній (arphi) = 10 В.
Задача 10. Металева кулька радіуса R1 = 1 см, що має заряд q = 1 нКл, оточений шаром діелектрика з проникністю (arepsilon=4,5) (рис. 11). Внутрішній радіус шару дорівнює радіусу кульки, зовнішній – R2 = 2 см. Визначити залежності напруженості E(r) і потенціалу (arphi(r)) від відстані r до центра кульки і побудувати графіки цих залежностей.
Два точкових заряди q1 = 1 нКл і q2 = -2 нКл знаходяться на відстані l = 100 см один від одного (рис.
Вектор напруженості поля в точці (рис. 5-1) дорівнює сумі векторів напруженості полів, створених у цій точці зарядами q1 і q2:
Модулі векторів E1 і E2 визначаються виразами:
Підставивши в останній вираз числові значення величин і врахувавши, що
У вершинах правильного трикутника зі стороною a = 10 см закріплені три точкових заряди q1 = 1 нКл, q2 = -2 нКл, q3 = -3 нКл, як показано на рис.
За принципом суперпозиції шуканий вектор
Відстань від кожного заряду до точки O
Звідси, врахувавши числові значення k = 9×109 м/Ф, q1 = 10-9 Кл і a = 0,1 м, для модуля E0 і кута (alpha) (див. рис. 6-1) дістанемо
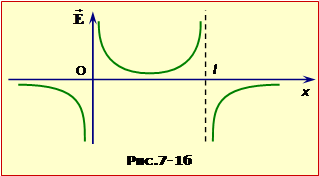
Два точкових заряди q і -q знаходяться на осі OX на відстані l один від одного (рис.

Додавши ці проекції, знаходимо для результуючого поля:
при x < 0:
при l > x > 0:
при x > l:
Графіки функцій (1), (2), (3), які є відповіддю задачі, показані на рис. 7-1б.
Визначити потенціал (arphi) краплі, що утворилася.
Система крапель є електроізольованою, тому її повний заряд зберігається, тобто заряд великої краплі q0 дорівнює сумі зарядів q1 маленьких крапельок:
q0 = nq1.
Будемо вважати, що краплинки до та утворена краплина після зливання мають форму кульок (нехтуємо дією сили тяжіння). Заряд і потенціал кулі зв’язані співвідношенням (10. 19б):
Тоді заряд кожної малої краплі
де R1 – її радіус.
Потенціал краплі, що утворилася
де R – радіус великої краплі. Для його знаходження врахуємо, що об’єм великої краплі V = nV1, де V1 – об’єм однієї маленької крапельки. Об’єм кулі
Підставивши цей вираз у формулу (1), знаходимо
Заряд q рівномірно розподілений по поверхні сфери радіуса R (рис.
А) напруженість E(r);
І напруженість, і потенціал будемо шукати за принципом суперпозиції (вирази (10. 5) і (10. 18)).
За принципом суперпозиції (формула (10. 18)) потенціал, який створюється всією сферою в точці O,
де q – заряд усієї сфери.
Потенціал у будь-якій точці усередині сфери і на її поверхні (r ≤ R) є однаковим:
У двох вершинах правильного трикутника зі стороною l = 10 см знаходяться однакові точкові заряди (рис. 10).
Визначити напруженість поля E в третій вершині правильного трикутника, якщо потенціал у ній (arphi) = 10 В.
Дано:l = 10 см = 0, 1 м(arphi) = 10 В
E – ?
Виразивши звідси q і підставивши його у формулу (1), маємо відповідь:
Металева кулька радіуса R1 = 1 см, що має заряд q = 1 нКл, оточений шаром діелектрика з проникністю (arepsilon=4,5) (рис. 11). Внутрішній радіус шару дорівнює радіусу кульки, зовнішній – R2 = 2 см.
залежності напруженості E(r) і потенціалу (arphi(r)) від відстані r до центра кульки і побудувати графіки цих залежностей.
Дано:R1 = 1 см = 0,01 мR2 = 2 см = 0,02 мq = 1 нКл = 10-9 Кл(arepsilon=4,5)
E(r) – ?(arphi(r)) – ?
Позитивний заряд кульки притягає до себе електрони і відштовхує ядра молекул діелектрика (це явище називається поляризацією діелектрика). Внаслідок цього на поверхнях діелектрика виникають так звані зв’язані заряди -q і +q (рис. 11-1). Ці заряди створюють у діелектрику власне поле, напрямлене протилежно полю зарядів кульки. Як наслідок, поле в діелектрику ослабляється в (arepsilon) разів ((arepsilon) – діелектрична проникність).

Величини зв’язаних зарядів можна визначити з наступних міркувань. У діелектрику напруженість поля (див. формулу (10. 6a)).
З іншого боку, напруженість поля в діелектрику дорівнює сумі векторів напруженості, створених у ньому зарядами кульки і зв’язаних зарядів q1 на внутрішній поверхні діелектричного шару. Заряди на зовнішній поверхні не створюють поля всередині сфери (див. задачу 10. Оскільки ці поля направлені протилежно, то
де q1 – модуль зв’язаного заряду на внутрішній поверхні діелектрика.
Порівнюючи праві частини виразів (1) і (2), після нескладних перетворень знаходимо
Діелектрик у цілому електрично-нейтральний, тому на зовнішній поверхні виникає позитивний зв’язаний заряд такої ж величини q1. Знаючи величини зв’язаних зарядів, легко визначити напруженість поля на будь-якій відстані від центра кульки, оскільки вже можна не розглядати діелектрик, а обчислювати напруженість і потенціал зарядів q, -q1 і +q1. Знаходимо напруженості для різних відстаней r (див. формули (10. 6a), (10. 6б)):
Потенціал електричного поля знаходимо як суму потенціалів полів, створених зарядами q, -q1 і +q1 (формули (10. 19a), (10. 19б)):
У числовому вигляді:
Звертаємо увагу на те, що на межі кулька-діелектрик і діелектрик-вакуум напруженість поля змінюється стрибком (див. рис. 11-2)
На відміну від напруженості потенціал поля є неперервною функцією r.

А) залежність від координати x проекції вектора напруженості;
А) Пластини ділять весь простір на три області: I, II, III (рис. 12). У кожній з цих областей обидві пластини створюють власні поля, модулі напруженості яких виражаються формулою (10. Результуючий вектор напруженості визначається за принципом суперпозиції:
Напрямки цих векторів у кожній області залежать від знаків заряду на пластинах.
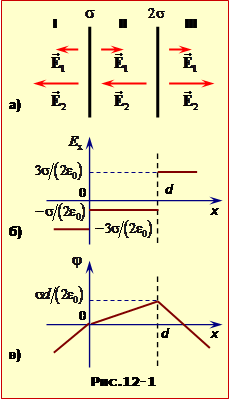
Графіки залежності Ex(x) показані на рис. 12-1б.

Оскільки модулі цих векторів однакові, проекція й модуль напруженості результуючого поля в кожній із трьох областей виявляється рівними:
Зауваження 1. Така ситуація характерна для плоского конденсатора. Тому на останній результат (формули (2)) варто звернути особливу увагу.
Зауваження 2. В обох випадках напрямок і модуль вектора напруженості залишається незмінним у будь-якій точці кожної області, тобто поле є однорідним.
Б) Для визначення залежності потенціалу від координати (arphi(x)) використаємо співвідношення (10. 15), яке зручно записати у вигляді
Підставляючи в цей функцію вирази модулів EI (1a) і EII (1б), і з огляду на те, що в області I (x < 0 ) і (cosalpha=1), а в області II – (cosalpha=-1), отримаємо
Графік (arphi(x)) для всіх трьох областей показаний на рис. 12-1в.
Графіки (arphi(x)) для всіх трьох областей показані на рис. 12-2в.
 gasu.gov.ru – ГАСУ Управление
gasu.gov.ru – ГАСУ Управление